PARTY FITNESZ - LŐRINCZ ERNŐ - Life1 Corvin - Interjú
Tartalomjegyzék:
- A funkciója az, hogy a CGM-érzékelő öt percenként leolvassa a glükózadatokat, és a szivattyúba beépített zárt hurkú algoritmus ezt az információt használja fel a bazális inzulin növelésére vagy csökkentésére, hogy a glükózszintet a lehető legközelebb tartsa a 120-as célnak mg / dl, a felhasználóknak még mindig be kell vezetniük a carb számításokat és bolus mennyiségeket az étkezéshez, és figyelmeztetniük kell a rendszert minden edzés előtt, és nem adnak automatikus korrekciós bólusokat a CGM alapján, de korrekciós összegeket javasol, ha egy ujjlenyomat eredmény ahogy az összes normál inzulinpumpa most a Bolus Wizard funkción keresztül történik.
- A nagy különbség az, hogy ezt az inzulinpumpa-CGM kombinációt egy kifinomult algoritmus vezérli. A Medtronic "SmartGuard Hybrid Closed Loop technológiáját" ismeri fel, amely szükség esetén az automatikus inzulin-beállítást és automatikus lekapcsolást teszi lehetővé. A termék jellemzői a következők:
- Igen, lesz egy frissítési útvonalat bárki a jelenlegi Medtronic termékek - úgynevezett Priority Access Program. Ez tényleg arra biztatja az ügyfeleket, hogy a következő hónapokban kezdjék el a Minimed 630G-ot, mielőtt a 670G megérinti a piacot, jelezve, hogy egy ilyen átmenet segít a betegeknek az új platformon történő edzéshez, és potenciálisan csökkenteni fogja a zsebkiadás költségeit, mint 0 dollár.
- Nagyon köszönöm mindazokat, akik részt vesznek - nem utolsósorban az FDA-nál is -, hogy ezeket a fontos cukorbetegség-gondozó eszközöket minden érdekünkben továbbítsák!
Wow, milyen óriási pillanat a Diabetes Közösségnek!
Szerdán az FDA jóváhagyta a Medtronic Minimed 670G-et, az első olyan "hibrid zárt hurkú rendszert", amely automatikusan követheti a glükózt, és beállíthatja a basalis inzulinadagokat az 1-es típusú cukorbetegségben lévő 14 éves és idősebb emberekben.

"Ez fantasztikus, és nagyon pszichológiai vagyok! "Mondja Aaron Kowalski, a JDRF fő küldetésszolgálatának vezetője és maga az 1. típusú ember. "Elképesztő, hogy ezen a szinten. Gondolj bele - ez az első alkalom, amikor az egyik (automatizált rendszer) jóváhagyásra került … és rövid idő alatt az FDA egyértelművé tette ezt. "
Tehát, csak mi ez az új glükóz kontrollrendszer, és hogyan működik?
Mi a hibrid lezárt hurok?A "hibrid" kifejezés ebben az esetben azt jelenti, hogy a rendszer részben automatizált, de még mindig szükség van bizonyos szintű ellenőrzésre a felhasználó számára.
A funkciója az, hogy a CGM-érzékelő öt percenként leolvassa a glükózadatokat, és a szivattyúba beépített zárt hurkú algoritmus ezt az információt használja fel a bazális inzulin növelésére vagy csökkentésére, hogy a glükózszintet a lehető legközelebb tartsa a 120-as célnak mg / dl, a felhasználóknak még mindig be kell vezetniük a carb számításokat és bolus mennyiségeket az étkezéshez, és figyelmeztetniük kell a rendszert minden edzés előtt, és nem adnak automatikus korrekciós bólusokat a CGM alapján, de korrekciós összegeket javasol, ha egy ujjlenyomat eredmény ahogy az összes normál inzulinpumpa most a Bolus Wizard funkción keresztül történik.
< ! - 1 ->
Ez az FDA-oldal szép munkát végez, amely részletezi a részleteket. A MiniMed 670G rendszernek két módja van, egy másik "autopilot", mint a másik, de mindkettő felhasználói beavatkozást igényel (tehát nem teljesen zárt hurkot):
Manual Mode- amelyen a rendszer programozható a felhasználó a bazális inzulint egy előre programozott állandó sebességgel szállítja.A rendszer automatikusan felfüggeszti az inzulin leadását, ha az érzékelő glükóz értéke alá esik, vagy várhatóan az előre meghatározott küszöbérték alá csökken. A rendszer automatikusan újraindítja az inzulin szállítását, ha a szenzor glükóz értéke meghaladja vagy előre jelzi, hogy egy előre meghatározott küszöb felett emelkedik.
a felhasználónak manuálisan kell inzulint adnia étkezés közben.
Kifelé, a Minimed 670G szinte megegyezik a vállalat nemrégiben jóváhagyott Minimed 630G készülékével, amely új, függőleges tájolású és színes kijelzővel látja el a Medtronic szabványos szivattyútervét.
A nagy különbség az, hogy ezt az inzulinpumpa-CGM kombinációt egy kifinomult algoritmus vezérli. A Medtronic "SmartGuard Hybrid Closed Loop technológiáját" ismeri fel, amely szükség esetén az automatikus inzulin-beállítást és automatikus lekapcsolást teszi lehetővé. A termék jellemzői a következők:
Szivattyúegység:

Mint már említettük, a megjelenés ugyanaz, mint a Minimed 630G, amelyet csak a múlt hónapban vezettek be (már elavult?). Ugyanaz az AA elem, ugyanazok az infúziós készletek és 300 egységnyi inzulintartály, és kicsit nagyobbak, mint a hagyományosan kialakított minimális szivattyúk vízszintes tájolással. Ezzel szemben a régebbi Medtronic szivattyúkkal ellentétben ez a készülék csak fekete színben kapható, de különböző bőröket is vásárolhat, ha kívánja.
- Gombok és menük: A 630G és az új MiniMed 670G között csak kis különbségek vannak az a tény, hogy a jobb felső gomb közvetlenül a CGM grafikonokhoz viszi a Menük felé vezető utat, és maga a menü is különbözik , tekintettel az új mód választási lehetőségekre stb., az új rendszeren.
- Színes képernyő: A 630G-hoz hasonlóan az új rendszer egy világos, színes képernyővel (!) Is rendelkezik, amely automatikusan beállítja a világítási helyzeteket, így például éjszaka nem fog olyan fényesen világítani, amennyire lehetséges napközben. Ez úgy tűnik, hogy sokkal könnyebben olvasható, nagy előny, hogy bárki szemmel láthatóan károsodik természetesen. Az alapszintű szivattyú és a CGM adatok mellett az Insulin on Board (IOB) közvetlenül a kezdőképernyőn jelenik meg - amit a felhasználók már felszólaltak.
- CGM Tech: Az új rendszer a Medtronic negyedik generációs kagyló alakú CGM érzékelőt használja, amelyet Enlite 3-nak neveztek, de most a Guardian 3 érzékelőként (
- a Storify összes különböző Medtronic kifejezéssel). Az FDA a testet 7 napig viseli, szemben a korábbi generációk 6 napjával.Semmi sem új a tapadó fronton. Megnövelt pontosság: A Guardian 3 megbízhatóbb és pontosabb, mondja a Medtronic, mert új rádiójelet (a 630G-al bemutatott) használ az adó és az érzékelő közötti kommunikációra. A cég napi két kalibrációjánál elvégzett klinikai központi vizsgálati adatok szerint az MARD hibaaránya átlagosan 10,55%, ami nem olyan jó, mint a legutolsó Dexcom G5 9% -ban, de sokkal jobb, mint a ~ 14% a jelenlegi Enlite kínál - így ez egy potenciális játékváltó, hogy a Medtronic erősebb versenytársává váljon a CGM piacon!

- A mód megváltoztathatja a következőket: A Medtronic azt állítja, hogy az emberek hallgatják az embereket arról, hogy nem akarnak választani, így lehetővé teszi a módok közötti váltást: a hibrid zárt hurkú funkció automatikus módja, vagy manuális mód, amely még mindig felfüggeszti az alacsony funkciót amikor átlépi a hipo küszöböt (mint például az 530G és a 630G mindkettő), és a Suspend Before Low (Alacsony felfüggesztés előtti), amely beállítható, hogy 30 perccel előrejelezhető a hipoosztás (mint a nemzetközileg elérhető 640G).
- BG Cél beállítása: Ez a technológia úgy tervezték, hogy "kezelje a célzás", vagyis azt jelenti, hogy a BG szintet lehetőleg közel 120 mg / dl értékig tartja. Sajnálatos módon ez nem változtatható meg … ami azt jelenti, hogy a Medtronic eddig csak a "személyre szabást és testreszabást" vonta maga után. A felhasználó 150 mg / dl ideiglenes célértéket állíthat be legfeljebb 12 órára, például az edzéshez hasonló helyzetek kezelésére, de ez az egyetlen rugalmasság a beépítésre. Medtronic szerint ez az első lépés a piacra jutásnak, mivel a különböző célok sokkal nagyobb klinikai vizsgálatot jelent, amely késleltette volna a hatósági engedélyezést és a forgalomba hozatalt. A jövő nemzedékek valószínűleg eltérő célszintet tesznek lehetővé, állítja Medtronic.

- A korábbi Minimed 630G rendszerhez hasonlóan ez a 670G Hybrid Closed Loop nem rendelkezik beépített Bluetooth-szal és nem működik a Minimed Connect a mobiltelefon adatmegosztásához ( ?!). Azok számára, akik adatmegosztásra vágynak, a Medtronic az elmúlt három évnél idősebbeknek hívta az embereket a Minimed 530G rendszerére. Ennek oka a kapcsolat, a 670G nem fog működni az IBM Watson vagy az adatok megosztását mobil alkalmazások fejlesztés alatt.
- Csatlakoztatott BG mérőegység: A rendszer úgy van beállítva, hogy közvetlenül a Bayer Contour Link 2. 4 méterrel kommunikáljon, amelyet az Ascensia bemutatott a 630G indító bejelentéssel. Ez lehetővé teszi a távoli bóluszt a mérőből, de csak kézi üzemmódban, nem pedig zárt hurkú automata üzemmódban.
- A rendszer 12 óránként legalább egy ujjlenyomat kalibrálást igényel, és ha nincs megadva, automatikusan kiveti a felhasználót az Auto módból.
- Egynyomású szerelő: A 670G a Medtronic új One-Press Serterjét használja, melynek köszönhetően megkönnyíti és kényelmesebbé teszi az érzékelő beillesztését. Ehhez csak egy gombnyomásra van szükség, szemben az előző generációs sorozattal, amely nagyobb volt, és két gombnyomást igényelt (egyszer beillesztésre és egyszer visszavonni).
- A minimális 670G hivatalosan 14 éves és annál idősebb, de a cég azt állítja, hogy már 7-13 éves korosztályban végez kísérleteket jóváhagyásra a gyerekeknél, valamint megvalósíthatósági tanulmányokat a 2 évesnél fiatalabbak számára. A jelenlegi FDA jóváhagyási levél kifejezetten kimondja, hogy a 670G nem használható 7 évesnél fiatalabbaknál, sem azoknál, akik naponta kevesebb mint 8 egységnyi inzulint fogyasztanak (mivel a készülék biztonságos napi minimális napi igénybevételét igényli). A Metronic azt állítja, hogy nincs elegendő adat azokban, akik kevesebb, mint 8 egységnyi napot igényelnek naponta, hogy tudják-e, hogy az algoritmus hatékony és biztonságos-e. Elérhetőség és költség
- A várhatóan gyorsabb várakozáson alapuló jóváhagyással a Medtronic azt mondja nekünk, hogy legalább hat hónapra van szükségük ahhoz, hogy előkészítsék az USA termékbevezetését 2017 tavaszán. Az Államokon kívül a Medtronic szerint elvárni a szabályozási jóváhagyást valamikor a 2017 közepén. Sok "mozgó alkatrész" létezik, amelyet itt kell elindítani Amerikában, magyarázzák, és jelenleg is a Minimed 630G indításának közepén állnak; hogy a korábbi modell csak nemrég indult el a betegek az U. S.
Igen, lesz egy frissítési útvonalat bárki a jelenlegi Medtronic termékek - úgynevezett Priority Access Program. Ez tényleg arra biztatja az ügyfeleket, hogy a következő hónapokban kezdjék el a Minimed 630G-ot, mielőtt a 670G megérinti a piacot, jelezve, hogy egy ilyen átmenet segít a betegeknek az új platformon történő edzéshez, és potenciálisan csökkenteni fogja a zsebkiadás költségeit, mint 0 dollár.
Elsődleges hozzáférési program kezdeti költsége = 799 $
Kereskedelmi jóváírás a MiniMed 630G szivattyúval és CGM rendszerrel = 500 $
A zsebprogram költségeinek teljes összege = csak 299 $
- A felmérésekben és más felhasználói visszacsatolási programokban való részvétel szintén csökkenti ezt a költséget, olyan alacsony, mint a $ 0 néhány ember számára, a vállalat szerint
- A Prioritási Hozzáférési Program 2017. április 28-ig tart. A Medtronic azt is mondja, hogy több ajánlatot és frissítési lehetőséget mutathatnak közelebb a tavaszi induláshoz.
- Természetesen a Medtronic az elkövetkező hónapokban is dolgozni fog a fizetőkkel és a biztosítótársaságokkal a technológia lefedettségével kapcsolatban. A legutóbbi vitákkal kapcsolatban (#DiabetesAccessMatters), reméljük, hogy a Medtronic szem előtt tartja, hogy míg sok beteg szeretne ezt a rendszert választani, ez nem feltétlenül a legjobb választás az összes - és a választási kérdésekben!
- 'A Watershed Moment … Diabetes Care átalakítása'
A JDRF szerdán kiadott egy sajtóközleményt, amely izgalmasan hangzott fel e mérföldkőnek számító technológiáról és arról, hogy az FDA gyorsan mozog. Az Amerikai Diabetes Szövetség is megjelent egy hírlevelet a jóváhagyásról, megjegyezve annak jelentőségét.
Gondolj bele: Tíz évvel ezelőtt sokan még mindig úgy gondolták, hogy bármilyen zárt hurkú rendszer volt csöves. De a JDRF valódi tervet mutatott be a mesterséges hasnyálmirigy felé. Ez még mindig a CGM technológia nagyon korai napja … és nézd meg, milyen messzire jutottunk!
Valójában az FDA piaci jóváhagyást adott ehhez a minimális 670G-hoz, ugyanakkor további, a piacra vonatkozó vizsgálatokat is megkövetelve, amelyek célja, hogy jobban megértsék, hogyan működik a készülék a valós környezetben. Ez azt mutatja, hogy az FDA hajlandó megvizsgálni a meglévő adatokat és bízni az előnyökben anélkül, hogy visszatartaná a jövőbeli adatokat.

Nagyon jó látni az FDA mozgását olyan gyorsan, nem csak a minimális 670G jóváhagyásnál, hanem az elmúlt években tapasztalható egyéb izgalmas cukorbetegséggel kapcsolatos technológiai és adatfejlesztésekkel. Nyilvánvaló, hogy az FDA felismeri a #WeAreNotWaiting mozgalmat, és mindent megtesz azért, hogy lépést tartson ezekkel a gyorsan változó időkben.
Az FDA jóváhagyja a Libre Pro
Érdemes megjegyezni, hogy az FDA szerdán zöld lámpát adott az Abbott Freestyle Libre Pro rendszerhez az Egyesült Államokban.Ez nem fogyasztói eszköz, hanem az Abbott az új Flash Glükóz Monitoring (FGM) technológiát, amely már a külföldön fekvő betegek számára is elérhető.
A "hibrid" rendszer - de csak a glükóz monitorozására utal - Az Abbott Libre egy kis kerek érzékelőből áll, amely legfeljebb 14 napig kopik a felső kar hátulján, és egy olyan vezérlő, amelyet a felhasználók csak átsiklannak több mint naponta szükség szerint, vagy a vezeték nélküli glükóz leolvasására.
Nem jelent semmilyen riasztást a glükóz szintek emelkedéséhez vagy csökkenéséhez, és a fogyasztói verzió csak 8 órányi adatot tárol.A cél az, hogy egy egyszerűbb monitoring megoldást hozzunk létre, amely szintén segíthet a 2-es típusú rendszereknek, hogy valós időben jobban érintkezzenek glükózszintjével.Bár nem egy hagyományos CGM, ahogy ismerjük, Abbott szerint a szabályozási szabályok a Libre-t CGM-ként osztályozzák. És most már jóváhagytak egy olyan verziót, amelyet kifejezetten az orvosok számára terveztek a betegek rövid távú használatához, és csak vakságot szolgáltat az orvosok megtekintésére. Ez az első lépés a fogyasztói verzió felé, amelyet az Abbott nemrégiben benyújtott az FDA jóváhagyásához.
Remélhetőleg hamarosan hamarosan az FDA látszólag megnövekedett innovációs gyorsasága lesz.
Nagyon köszönöm mindazokat, akik részt vesznek - nem utolsósorban az FDA-nál is -, hogy ezeket a fontos cukorbetegség-gondozó eszközöket minden érdekünkben továbbítsák!
: A Diabetes Mine csapata által létrehozott tartalom. További részletekért kattintson ide.
Jogi nyilatkozat
Ez a tartalom a cukorbetegség közösségére összpontosító, a cukorbetegek bányájára készült. A tartalom nem orvosilag felülvizsgálható, és nem tartja be az egészségügy szerkesztői irányelveit. Ha többet szeretne megtudni a Healthline Diabetes Bánya partnerségéről, kattintson ide.
Zárt szög[SET:h1hu]Zárt szögű glaukóma
Zárt zugú glaukóma olyan szemkörülmény, amelyet a szemed túl nagy nyomása okoz. Tudjon meg többet a zárt zugú glaukóma típusairól és tüneteiről.
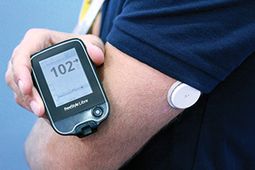
A Medtronic 670G cukorbeteg zárt rendszerű rendszer tesztelése

Egy Minnesota férfi egyike azon 15 embernek, akik egy Minimális 670G, mesterséges hasnyálmirigy-rendszer előfutára.
ILet, Bigfoot és mások: a cukorbetegséggel kapcsolatos zárt hurkú rendszerek Zárt hurkú technikai frissítés




